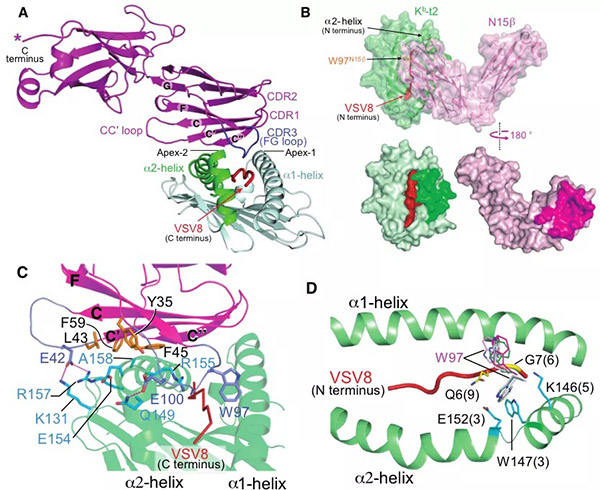
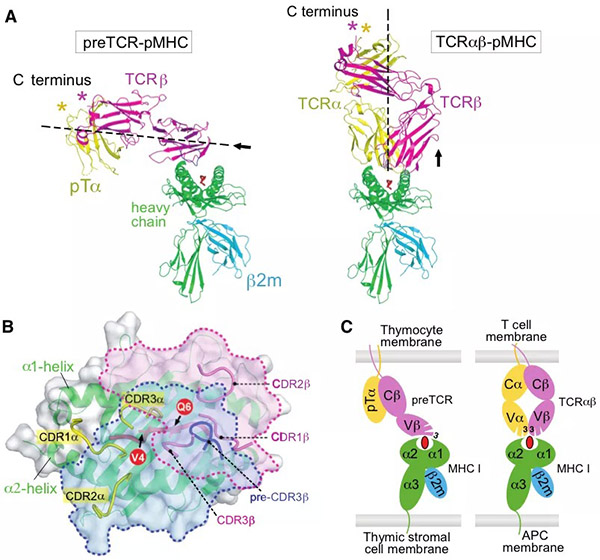
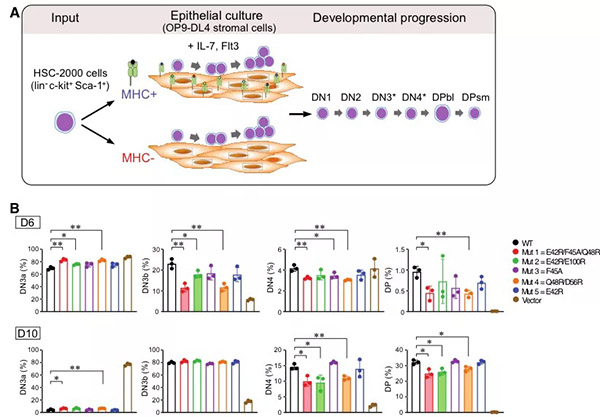
主要组织相容性复合体 (major histocompatibility complex, MHC) 限制性T 淋巴细胞 (T 细胞) 介导的细胞免疫,在脊椎动物的免疫系统中扮演着极重要的角色。近年来,T 细胞免疫应答机制的研究与应用促进了细胞免疫治疗的长足发展,也让免疫治疗成为学术界与工业界追捧的热点领域之一。对T细胞深入的基础研究,将有助于对免疫系统的透彻理解与推动进一步在医学领域的应用。这其中也包括对T细胞发育的研究。每个T细胞克隆在它表面表达一个特定的T细胞受体(TCR)。它能识别由MHC分子递呈到宿主细胞表面的来自于外源病原体或由癌变细胞产生的特异抗原。TCR由α链和β链组成。为了应对成千上万的抗原,TCR的α链和β链由DNA的片段重组机理来产生对应的专一性的TCR分子。T 细胞的谱系发育决定完成于胸腺。由造血干细胞(HSC)分化发育而来的淋巴细胞前体经骨髓迁移到胸腺后的初始阶段是不表达TCR, 与其辅助受体CD4 和 CD8分子的,被称为“双阴性阶段” (double negative stage,DN)。随着细胞的分化发育过程,TCR, CD4和CD8共同表达于T细胞表面,称为“双阳性阶段”(double positive stage,DP)。而后,在TCR的配体 I 型MHC (MHC-I)或 II型MHC (MHC-II) 选择下,进入“单阳性阶段”(single positive stage, SP),即形成MHC-I限制的 CD8+ T 细胞 与 MHC-II限制的CD4+ T 细胞。从DP 到SP的过程为T细胞的“阳性选择”。随着T细胞在胸腺继续迁移,对自身抗原分子具有过强亲和力,可能引发自身免疫的T细胞会接受细胞凋亡信号而凋亡,最终只存留具有一定免疫耐受的 naïve T 细胞。这个过程被称为T细胞的“阴性选择”。经过DN—DP—SP—“阳性选择”—“阴性选择”后,T细胞离开胸腺进入次级淋巴器官形成我们所熟悉的具有特定功能的T细胞的前体。而在整个T细胞分化过程中最不清楚的环节之一是DN的中间阶段, 该阶段可分为DN1,DN2,DN3以及DN4,也是TCR初始表达、选择的关键。在DN2阶段, TCR-β链经过DNA的V-D-J重排、首先表达,随后进入DN3,一个关键的所谓“TCR-β选择”阶段。在此阶段,TCR-β与一个α链前体(preTα 或 pTα)组合形成二聚体,即preTCR。在大量处于DN3发育阶段的细胞中,只有那些其preTCR由有功能的TCR-β组成的细胞才得以进入下一步发育,其它多数TCR-β重组不成功的细胞则被淘汰。在preTCR介导的信号成功激活后,经过基因重排的TCR-α链会取代preTα链并与TCR-β形成新的二聚体,即具有能识别抗原的TCRαβ。 随后,表达成熟TCRαβ 的 T细胞逐步进入上述DP阶段。大量的实验表明,preTCR在T细胞分化的“TCR-β选择”过程发挥着无可替代的作用,然而preTCR如何介导相应信号,preTCR 介导的信号激活是否需要配体,长期以来在该领域中始终存在争议。现行各版免疫学教科书中,“TCR-β选择”依然处于相对空白状态。更多的研究工作者并不认为配体是必要的【1-2】,而是通过preTCR/preTCR自发形成二聚体完成信号激活【3-4】。但越来越多生化、单分子、及基因序列分析等证据表明,这种preTCR/preTCR二聚假说可能是不成立的,且preTCR的信号激活需要pMHC【5-6】。2020年12月17日,哈佛大学医学院/Dana-Farber Cancer Institute 的Ellis L. Reinherz 和王家槐教授组(Reinherz/Wang团队)在Science上在线发表了题为 Pre-T cell receptors topologically sample self-ligands during thymocyte β-selection 的研究论文(第一作者:李小龙博士,Réka Mizsei博士)。该研究利用x射线晶体学解析了preTCRβ-pΜΗC-I复合物结构 (图1, A), 揭示preTCR如何通过preTCRβ单一结构域拓扑性识别结合自身抗原的ΜΗC配体分子(图1,A和B),为T细胞分化发育,特别是“TCR-β选择”的研究翻开了崭新的一页。图1. A) preTCRβ-Kb-t2复合物的结构模型(preTCRβ:洋红,Kb-t2:绿;肽:红)。Β) preTCRβ-Kb-t2相互作用界面的拓扑展开。C) 参与相互作用的部分关键氨基酸。D) 三个独立晶体结构共计九个TCRβ 的CDR3顶端氨基酸Trp97在MHC-I抗原结合部位的分布。注:图片来自原文由于preTCR-pΜΗC的相互作用十分微弱,通过常规的蛋白-蛋白混合形成晶体非常困难。依据已有的研究,preTCR-pΜΗC相互作用是通过preTCRβ与pΜΗC的抗原结合域(α1,α2)。Reinherz/Wang团队首先将preTCR与pΜΗC分别进行简化处理,即仅使用preTCRβ与Kb-t2(鼠源MHC-I的α1,α2),并定点在preTCRβ和Kb-t2上引入半胱氨酸,然后通过修饰的PEG连接分子(BMPEG3)将preTCRβ与pΜΗC交联在一起,并成功获取复合物晶体。晶体结构显示,TCRβ用其可变功能域 Vβ (variable domain of chain β) 拓扑性地结合于 Kb-t2的α2螺旋上,并使用其non-germline抗原决定簇 (complementarity-determining region-3, CDR3) “探视”结合于ΜΗC抗原结合沟槽中的肽段(图1,A和D),而germline CDR1与CDR2则被排除在相互作用的界面之外(图1, A)。形象地说,整个相互作用界面就如一个弯曲的手掌(TCRβ)抓在一个柱形体(α2)上,并用一根手指(CDR3)特异性地”钳住” α2一侧的抗原肽,另一根手指(CC’ loop)则“钳住”α2的另一侧,而掌心的疏水性氨基酸则堆积在α2正上方并与相应氨基酸的脂肪链形成疏水作用(图1, C)。总体结果使得相互作用界面的形状互补度(shape complementarity, Sc)和包埋面积(buried surface area, BSA)达到蛋白-蛋白相互作用的正常范围内。当把完整的preTCR与pΜΗC分子结构同时叠合到preTCRβ-Kb-t2复合物结构上,可以清楚地看到,与TCRαβ-pΜΗC复合物结构中的“头-头”的垂直相互作用相比(图2, A右; C右),preTCR-pΜΗC复合物则是“水平”抓握式相互作用(图2, A左; C左)。相应地也使得preTCR的Vβ 与TCRaβ的Vβ在pMHC相互作用表面投影区域截然不同(图2, B)。这是一个完全出乎免疫学家意料之外的发现。图2. A-左) 完整的preTCR与Kb 结构同时叠合在preTCRβ-Kb-t2上的preTCR-pMHC-I结构模型(preTCRβ:洋红;pre-Tα:黄;Kb:绿;肽:红);A-右) 经典 TCRaβ-pMHC-I复合物结构模型。Β) preTCR的Vβ 与TCRaβ的Vβ分别在pMHC相互作用表面投影(preTCR-Vβ:浅蓝;TCRaβ-Vβ:浅红)。C) preTCR-pMHC-I与TCRaβ-pMHC 在细胞表面上的卡通示意图。注:图片来自原文为了进一步验证该相互作用,Reinherz/Wang团队尝试了将化学交联位点、抗原肽进行改变,并获得样品和晶体结构。结果显示,三个独立结构的preTCR-pΜΗC相互作用一致。此外,NMR技术相关实验数据也在文章中予以展示。更为重要地,根据晶体结构界定的相互作用,该团队利用小鼠模型,进行一系列的TCR关键相互作用位点突变。基于DN3a 至DP阶段的数据分析,晶体结构中观测到的关键相互作用的破坏会显著地影响到小鼠Τ细胞的分化(图3),进一步证明preTCR-pΜΗC的复合物结构的生物学相互作用。图3. A) T细胞发育示意图 。Β) 基于图一C)结构分析设计的preTCRβ突变的小鼠T细胞分化实验。注:图片来自原文总而言之,本文第一次报道了可视化的preTCR-pΜΗC复合物晶体结构,提出了preTCR的拓扑结构与CDR3在“TCR-β选择”中重要作用,为研究preTCR介导的T细胞分化发育的科学工作者,提供了一个新的思考空间。https://science.sciencemag.org/cgi/doi/10.1126/science.abe09181. B. H. Koller, P. Marrack, J. W. Kappler, O. Smithies, Normal development of mice deficient in beta 2M, MHC class I proteins, and CD8+ T cells. Science. 248, 1227-1230 (1990).2. M. J. Grusby, H. Auchincloss Jr., R. Lee, R. S. Johnson, J. Spencer, M. Zijlstra, R. Jaenisch, V. E. Papaioannou, L. H. Glimcher, Mice lacking major histocompatibility complex class I and class II molecules. Proc Natl Acad Sci USA. 90, 3913-3917 (1993).3. S. S. Pang, R. Berry, Z. Chen, L. Kjer-Nielsen, M. A. Perugini, G. F. King, C. Wang, S. H. Chew, N. L. La Gruta, N. K. Williams, T. Beddoe, T. Tiganis, N. P. Cowieson, D. I. Godfrey, A. W. Purcell, M. C. Wilce, J. McCluskey, J. Rossjohn, The structural basis for autonomous dimerization of the pre-T-cell antigen receptor. Nature. 467, 844-848 (2010).4. S. Yamasaki, E. Ishikawa, M. Sakuma, K. Ogata, K. Sakata-Sogawa, M. Hiroshima, D. L. Wiest, M. Tokunaga, T. Saito, Mechanistic basis of pre-T cell receptor-mediated autonomous signaling critical for thymocyte development. Nat Immunol. 7, 67-75 (2006).5. P. Smelty, C. Marchal, R. Renard, L. Sinzelle, N. Pollet, D. Dunon, T. Jaffredo, J.-Y. Sire, J. S. Fellah, Identification of the pre-T-cell receptor alpha chain in nonmammalian vertebrates challenges the structure-function of the molecule. Proc Natl Acad Sci USA. 107, 19991-19996 (2010).6. B. Zhou, Q. Chen, R. J. Mallis, H. Zhang, J. H. Liu, E. L. Reinherz, J. H. Wang, A conserved hydrophobic patch on Vβ domains revealed by TCRβ chain crystal structures: Implications for preTCR dimerization. Front Immunol. 2, 5 (2011).